Les humains n'auraient pas existé sans virus car la protéine virale joue un rôle clé dans le développement de l'embryon humain. Cependant, ils constituent parfois des menaces existentielles sous la forme de maladies, comme dans le cas de la pandémie actuelle de COVID-19. Ironiquement, les virus représentent environ 8 % de notre génome, qui a été acquis au cours de l'évolution, ce qui fait de nous « pratiquement une chimère ».
Le mot le plus tristement célèbre et terrible de l'année 2020 est sans aucun doute 'virus'. Le roman coronavirus est responsable de l'actuelle maladie COVID-19 sans précédent et d'un quasi-effondrement de l'économie mondiale. Tout cela est causé par une minuscule particule qui n'est même pas considérée comme « pleinement » vivante car elle est dans un état non fonctionnel à l'extérieur de l'hôte, tout en ne se perpétuant à l'intérieur qu'en infectant l'hôte. Plus surprenant et choquant est le fait que le les humains portent les «gènes» viraux depuis des temps immémoriaux et actuellement, les gènes viraux constituent environ 8 % du génome humain (1). Pour mettre cela en perspective, seulement ~1% du génome humain est fonctionnellement actif, responsable de la fabrication de protéines qui déterminent qui nous sommes.
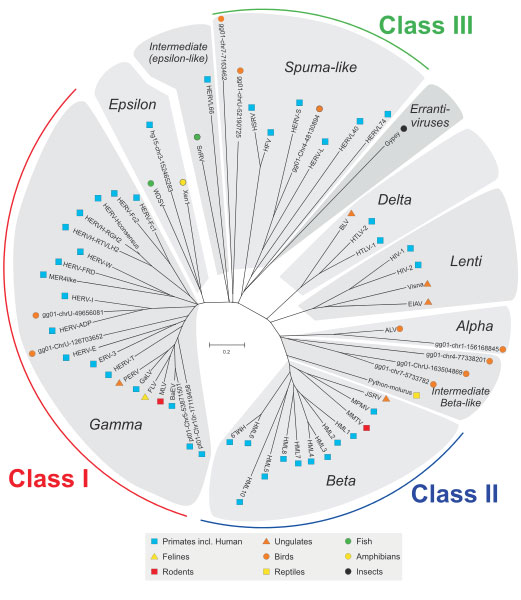
L'histoire de la relation entre les humains et virus started 20-100 million years ago when our ancestors got infected by virus. Each endogenous retrovirus family is derived from a single infection of the germline cells by an exogenous retrovirus that after integrating into our ancestor, expanded and evolved (2). The propagation followed by the horizontal transfer from parents to offspring and today we have these viral genomes embedded in our DNA as human endogenous retroviruses (HERVs). This is a continuous process and may even be happening at the moment. Over the course of evolution, these HERVs acquired mutations, became stabilised in the human genome and lost their ability to cause the disease. The endogenous rétrovirus are not only present in humans but are omnipresent in all living organisms. All these endogenous retroviruses grouped into three classes (Class I, II and III) occurring across different animal species exhibit a phylogenetic relationship based on their sequence similarity (3) as depicted in Figure below. HERVs belong to the Class I group.
Of the various embedded retroviruses present in the human genome, a classic example worth mentioning here, is that of a retroviral protein that is highly fusogenic envelope protein called syncytin, (5) whose original function in the virus was to fuse with host cells to cause infection. This protein has now been adapted in humans to form placenta (fusion of cells to make multinucleated cells) that not only provides food to foetus from the mother during pregnancy but also protects the foetus from the mother’s immune system due to the immunosuppressive nature of the syncytin protein. This particular HERV has proven to be beneficial to the human race by defining its very existence.
HERVs have also been implicated in providing innate immunity to the host by preventing further infection from related viruses or reducing the severity of the disease upon re-infection by similar type of virus. A 2016 review by Katzourakis and Aswad (6) describes that endogenous viruses can act as regulatory elements for genes that control immune function, thereby leading to immunity development. In the same year, Chuong et al (7) demonstrated that certain HERVs act as regulatory enhancers by modulating the expression of IFN (interferon) inducible genes thereby providing innate immunity. HERV expression products can also act as pathogen-associated molecular patterns (PAMPs), triggering the cellular receptors responsible for host first line of defences (8-10).
Un autre aspect intéressant des HERV est que certains d'entre eux présentent des polymorphismes d'insertion, c'est-à-dire qu'un nombre différent de copies sont présentes dans le génome en raison d'événements d'insertion. Une étude de 20 sujets appartenant à différents groupes ethniques a révélé des modèles de polymorphisme d'insertion compris entre 0 et 87 % chez tous les sujets (11). Cela peut avoir des implications en provoquant des maladies par l'activation de certains gènes qui sont autrement silencieux.
Il a également été démontré que certains HERV sont associés au développement de troubles auto-immuns tels que la sclérose en plaques (12). Dans des conditions physiologiques normales, l'expression de HERV est étroitement régulée tandis que dans des conditions pathologiques dues à des changements dans l'environnement externe/interne, des changements hormonaux et/ou une interaction microbienne peuvent provoquer un dérèglement de l'expression de HERV, entraînant une maladie.
Les caractéristiques ci-dessus des HERV suggèrent que non seulement leur présence dans le génome humain est inévitable, mais qu'ils possèdent la capacité de réguler l'homéostasie du système immunitaire en l'activant ou en le supprimant, provoquant ainsi des effets différentiels (d'être bénéfique à provoquer une maladie) dans hôtes.
The COVID-19 pandemic is also caused by a retrovirus SARS-nCoV-2, that belongs to the influenza family, and it may be plausible that, during the course of evolution, genomes related to this family of virus got integrated into the human genome and are now present as HERVs. It is surmised that these HERVs might exhibit different polymorphisms, as mentioned above, among people of different ethnicity. These polymorphisms may be in the form of differential copy number of these HERVs and/or presence or absence of mutations (changes in the genome sequence) accumulated over a period of time. This variability in the integrated HERVs may offer an explanation for the differential mortality rates and the severity of COVID-19 disease in different countries effected by the pandemic.
***
Références:
1. Griffiths DJ 2001. Rétrovirus endogènes dans la séquence du génome humain. Génome Biol. (2001); 2(6) Avis 1017. DOI : https://doi.org/10.1186/gb-2001-2-6-reviews1017
2. Boeke, JD; Stoye, JP (1997). « Rétrotransposons, rétrovirus endogènes et évolution des rétroéléments ». Dans Coffin, JM; Hughes, SH; Varmus, HE (éd.). Rétrovirus. Presse de laboratoire Cold Spring Harbor. PMID 21433351.
3. Vargiu L, et al. Classification et caractérisation des rétrovirus endogènes humains ; les formes en mosaïque sont courantes. Rétrovirologie (2016) ; 13 : 7. DOI : 10.1186 / s12977-015-0232-y
4. Classes_of_ERVs.jpg : Jern P, Sperber GO, Blomberg J (œuvre dérivée : Fgrammen (talk)), 2010. Disponible en ligne sur https://commons.wikimedia.org/wiki/File:Classes_of_ERVs.svg Consulté le 07 mai 2020
5. Blond, JL; Lavillette, D; Cheynet, V; Bouton, O; Oriol, G; Chapel-Fernandes, S; Mandrandes, S; Mallet, F; Cosset, FL (7 April 2000). “An envelope glycoprotein of the human endogenous rétrovirus HERV-W is expressed in the human placenta and fuses cells expressing the type D mammalian retrovirus receptor”. J. Virol. 74 (7): 3321–9. DOI: https://doi.org/10.1128/jvi.74.7.3321-3329.2000.
6. Katzourakis A, and Aswad A. Evolution: Endogenous Virus Provide Shortcuts in Antiviral Immunity. Current Biology (2016). 26: R427-R429. http://dx.doi.org/10.1016/j.cub.2016.03.072
7. Chuong EB, Elde NC et Feschotte C. Évolution régulatrice de l'immunité innée par cooptation de rétrovirus endogènes. Sciences (2016) Vol. 351, numéro 6277, pages 1083-1087. EST CE QUE JE: https://doi.org/10.1126/science.aad5497
8. Wolff F, Leisch M, Greil R, Risch A, Pleyer L. L'épée à double tranchant de la (ré)expression des gènes par des agents hypométhylants : du mimétisme viral à l'exploitation comme agents d'amorçage pour la modulation ciblée des points de contrôle immunitaire. Signal de communication cellulaire (2017) 15:13. EST CE QUE JE: https://doi.org/10.1186/s12964-017-0168-z
9. Hurst TP, Magiorkinis G. Activation of the innate immune response by endogenous rétrovirus. J Gen Virol. (2015) 96:1207–1218. DOI: https://doi.org/10.1099/vir.0.000017
10. Chiappinelli KB, Strissel PL, Desrichard A, Chan TA, Baylin SB, Correspondence S. L'inhibition de la méthylation de l'ADN provoque une réponse d'interféron dans le cancer via l'ARNdb, y compris les rétrovirus endogènes. Cell (2015) 162:974-986. EST CE QUE JE: https://doi.org/10.1016/j.cell.2015.07.011
11. Mehrab G, Sibel Y, Kaniye S, Sevgi M and Nermin G. Human endogenous rétrovirus-H insertion screening. Molecular Medicine Reports (2013). DOI: https://doi.org/10.3892/mmr.2013.1295
12. Gröger V et Cynis H. Rétrovirus endogènes humains et leur rôle putatif dans le développement de troubles auto-immuns tels que la sclérose en plaques. Microbiol avant. (2018); 9 : 265. DOI : https://doi.org/10.3389/fmicb.2018.00265
***